Im letzten Abschnitt stellten wir den sehr geringen Einfluss von Änderungen der H2-Konzentration auf den ORP-Wert fest, während der pH bei genau 7 gehalten wurde. Um den Einfluss zu untersuchen, den Änderungen auf den pH-Wert des ORP haben, werden wir nun schrittweise nur den pH-Wert ändern, während wir die H2-Konzentration bei 1,6 mg/l halten.
Da das ORP mit abnehmendem pH-Wert positiver wird, hat eine gelöste H2-Konzentration von 1,6 mg/l bei einem pH-Wert von Null ein ORP von null Millivolt.
Wie Sie sehen werden, wird der Grad, in dem der pH-Wert das ORP beeinflusst, im Vergleich zum Einfluss von H2 noch überzeugendere Beweise liefern, die zeigen, warum der ORP-Messwert nicht zur Messung von H2 verwendet werden kann.
Zuvor beobachteten wir die geringen Auswirkungen von Änderungen der H2-Konzentration bei der Eingabe von Werten in den Nernst-Rechner aus einem typischen Bereich von H2-Konzentrationen (0,5 bis 2 mg/l).
Da, wie bereits gesagt, die Konzentrationen sowohl der H2 als auch der H+ Spezies zum Redoxpotential beitragen, wird eine Änderung eines der beiden Faktoren eine Veränderung bei der ORP-Messung bewirken.
Eine wichtige Frage, die wir uns stellen müssen, ist: „Tragen die jeweiligen Faktoren gleichermaßen zur Änderung des ORP bei?“.
Um diese Frage beantworten zu können, schauen wir uns nun an, wie sich Änderungen des pH-Werts auf das ORP auswirken. Um einen gültigen Vergleich durchführen zu können, werden wir (wie schon bei H2) einen typischen Bereich von pH-Werten verwenden.
Das Diagramm in Figure 9 zeigt die vorhergesagten ORP-Messwerte (in Millivolt) für vier verschiedene pH-Werte, alle bei gleicher gelöster H2-Konzentration von 1,6 mg/l.
Die Grafik zeigt, wie ein Anstieg nur des pH-Werts (unter Beibehaltung eines konstant gelösten H2 -Niveaus) die ORP-Messung beeinflusst. Bei einem pH-Wert von 7 misst Wasserstoffwasser mit einer Konzentration von 1,6 mg/l einen ORP-Wert von -414 mV. Wenn der pH-Wert von 7 auf 10 ansteigt, bemerken Sie den starken Anstieg des negativen Redoxpotentials von -414 mV auf -592 mV.
Über diesen Bereich von nur drei pH-Einheiten wird das vorhergesagte ORP um 178 Millivolt negativer! Denken Sie daran, dass der Anstieg des negativen ORP nur das Ergebnis des Anstiegs des pH-Werts (Abnahme von H+) ist, während die H2-Konzentration unverändert bei 1,6 mg/l bleibt.

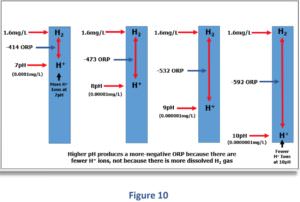
Wenn der pH-Wert ansteigt, nimmt die H+-Konzentration ab, was das negative Redoxpotential erhöht, das durch das H+/H2 Redoxpaar erzeugt wird.
Als Konsequenz wird der ORP-Messwert negativer, nicht weil die gelöste H2-Konzentration zugenommen hat, sondern weil die H+-Konzentration abgenommen hat; mit anderen Worten, nicht weil etwas dem Wasser hinzugefügt wurde, sondern weil etwas aus dem Wasser entfernt wurde!
Dieser starke Anstieg des negativen Redoxpotentials tritt ohne Änderung der H2-Konzentration auf. Da das ORP fast ausschließlich auf Änderungen des pH-Werts reagiert, liefert die Größe des ORP-Wertes daher keine brauchbare Information über den tatsächlichen Gehalt an gelöstem H2 im Wasser.
Auszug aus dem Buch von Randy Sharpe: „Der Zusammenhang zwischen gelöstem H2, pH-Wert und Redoxpotential“




